Chemie
Verwendet wird CO2 zum einen in der Getränkeindustrie, aber auch zur Neutralisation basischer Abwässer. Da die entstehenden Carbonate stark puffern und die Kohlensäure eine nur schwache Säure ist, bilden sich weitgehend neutrale Abwässer ohne aufwendige Kontrolle. Durch seine Ungiftigkeit und Umweltfreundlichkeit ist CO2 daher gut geeignet für solche Aufgaben.
Nach folgender Reaktionsgleichung bildet sich aus Wasser und CO2 Kohlensäure:
CO2 + H20 ![]() H2CO3
H2CO3
Das Gleichgewicht liegt dabei aber zu 99,9 % auf der linken Seite der Gleichung. Der Rest des CO2 ist physikalisch im Wasser gelöst. Daher kann der pH-Wert CO2-haltiger Wasserlösungen höchstens auf 3,7 (Normaldruck) bzw. 3,3 (Grenzwert unter Druck) absinken.
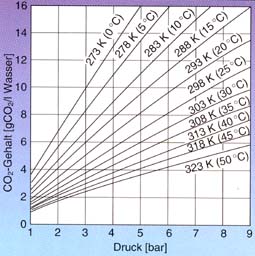
Löslichkeit
Die für den Aquarianer wichtige Eigenschaft ist die leichte Löslichkeit in Wasser. Sie ist in hohem Maße von der Temperatur und dem Druck abhängig. Bei niedriger Temperatur und hohem Druck löst sich mehr CO2 in Wasser.
Weitere im Wasser gelöste Stoffe wie Salze, Zucker, Dextrin, Stärke vermindern die Löslichkeit, Eisenhydroxide und Gelatine können sie erhöhen (Größenordnung +5 bis -10 %).
Der überkritische Zustand
Ein sich im Phasendiagram oberhalb des kritischen Punktes befindliches Gas ist im sog. überkritischen Zustand (bei CO2: T = 31 °C, p = 74 bar). CO2 in diesem Zustand hat hervorragende Lösungsmitteleigenschaften. Diese sind sehr selektiv und ändern sich bei geringen Variationen der Parameter sehr stark. So kann mit sehr geringem Energieaufwand ein Stoff erst extrahiert und dann nach einer geringen Änderung der Parameter wieder abgeschieden werden.
Technisch genutzt wird das z.B. bei der Entkoffeinierung von Kaffee oder Tee, der Reduzierung von Nikotin im Tabak für Leichtmarken und der Herstellung von Pflanzenextrakten aus Hopfen und anderen Gewürzen.

