Volvox sp.
Biologie
Die kugelförmige Grünalge Volvox sp. markiert in der Entwicklung vom Einzeller hin zum Vielzeller das Stadium direkt nach der Konstitution der ersten Vielzeller. Sie ist die fortgeschrittenste und größte Geiselträgerkolonie (bis zu 2 mm Durchmesser), bestehend aus sehr vielen Einzelzellen (max. 20.000), die in regelmäßigen Abständen in der Wandung einer Gallerthohlkugel stecken und ihre 2 Geißeln nach außen kehren. Jede Einzelzelle ist mit ihren Nachbarn durch Plasmabrücken verbunden.
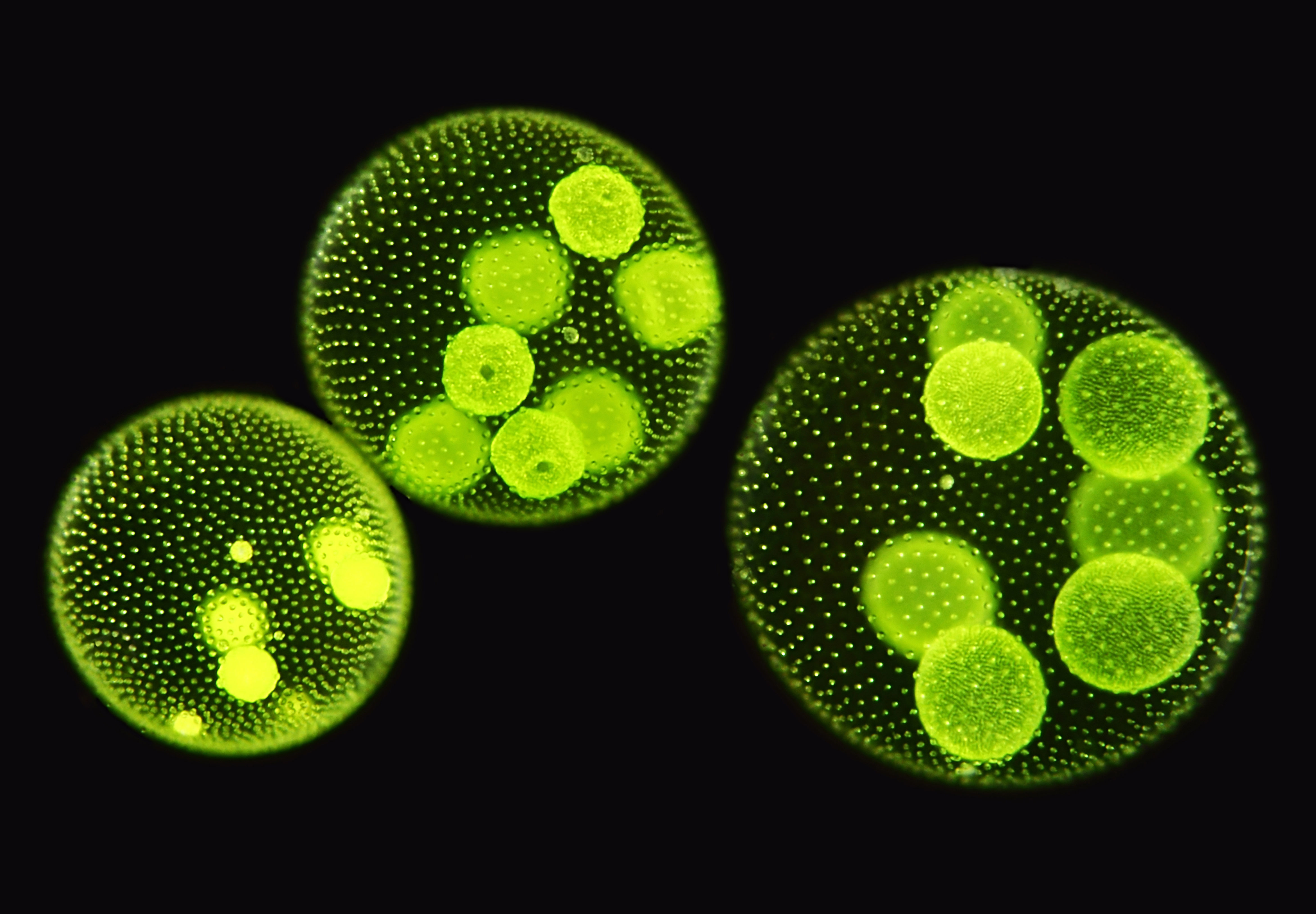
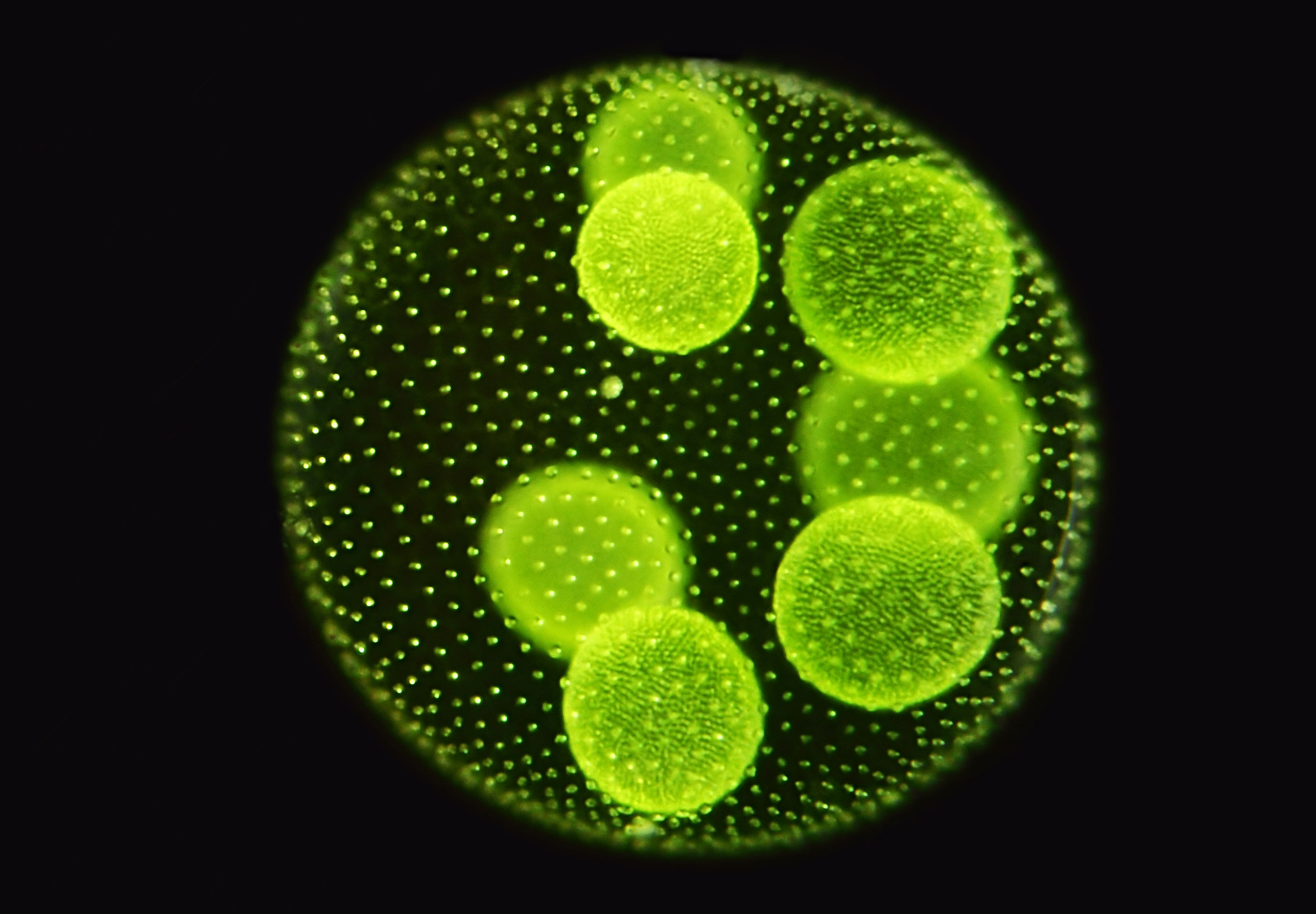
Die Fortbewegung geschieht durch den gemeinsamen Geißelschlag aller Zellen. Die vorderen Zellen haben größere Augenflecke und sind lichtempfindlicher als die Zellen am hinteren Pol. Zur Vermehrung sind nur noch wenige Zellen am Hinterende der Kolonie fähig (Bildung erster Keimzellen!); sie sind größer und werden bei ihrer Teilung ins Innere der Kolonie gedrängt. Dort wachsen sie dann zur neuen Kolonien heran, welche nach dem Aufplatzen der Mutterkolonie frei werden.
Auf dieser Stufe der Entwicklung der Lebewesen hat nun auch der Tod Einzug gehalten. Sich durch Spaltung vermehrende Einzeller waren und sind ja prinzipiell unsterblich.
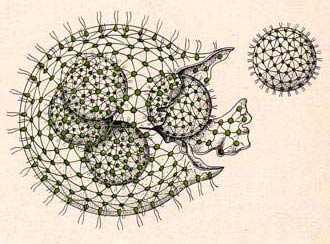
In Folge die schematische Darstellung aus einem alten Schulbuch. Links werden die die Plasmabrücken zwischen den Zellen gezeigt. Nur die größere Zelle ist vermehrungsfähig. Rechts die schematische Darstellung des Moments in dem die Mutterkolonie aufplatzt und die Tochterkolonien freigibt.
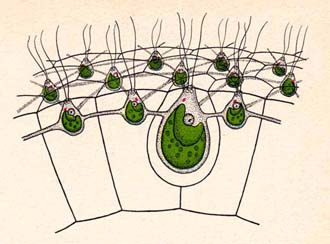
Hier die schematische Darstellung aus einem alten Schulbuch.
Links werden die die Plasmabrücken zwischen den Zellen gezeigt. Nur die größere Zelle ist vermehrungsfähig.
Rechts die schematische Darstellung des Moments in dem die Mutterkolonie aufplatzt und die Tochterkolonien freigibt.
Die Fortbewegung geschieht durch den gemeinsamen Geißelschlag aller Zellen. Die vorderen Zellen haben größere Augenflecke und sind lichtempfindlicher als die Zellen am hinteren Pol. Zur Vermehrung sind nur noch wenige Zellen am Hinterende der Kolonie fähig (Bildung erster Keimzellen!); sie sind größer und werden bei ihrer Teilung ins Innere der Kolonie gedrängt. Dort wachsen sie dann zur neuen Kolonien heran, welche nach dem Aufplatzen der Mutterkolonie frei werden. Auf dieser Stufe der Entwicklung der Lebewesen hat nun auch der Tod Einzug gehalten. Sich durch Spaltung vermehrende Einzeller waren und sind ja prinzipiell unsterblich.
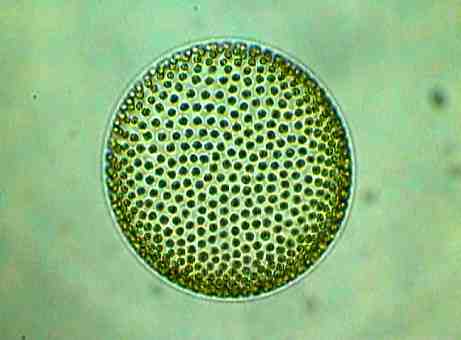
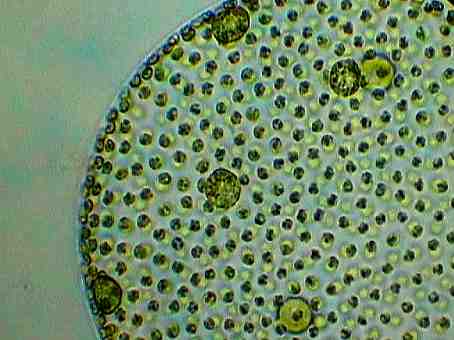
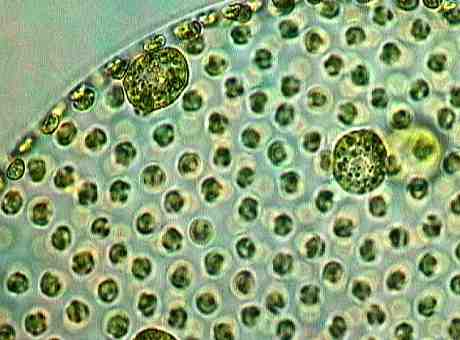
Die Bilder dieser Volvox-Art, bei denen man auch die Tochterkoloniebildung sehr gut erkennen kann, wie auch die nachfolgenden Bilder, stammen von Günter H. Stanjek (das Copyright der Photos liegt ausschließlich bei ihm).
Der Vollständigkeit halber gebe ich hier noch den Kommentar von G. H. Stanjek zu der photografierten Volvox sp. an:
„Es ist allerdings noch anzumerken, daß es sich hier um eine sehr kleine Art handelt, die nicht näher bestimmt werden konnte. Sie weicht in der Größe, sowie im Habitus beträchtlich von anderen, bekannteren Arten ab, die normalerweise nur in eutrophen Gewässern vorkommen.”
Nachfolgend noch einige weitere Bilder von Volvox sp. in diversen Stadien
Die Wimperkugel Volvox liebt eutrophe Gewässer, in denen sie manchmal in dichten Wolken zu beobachten ist. Die einzelnen, bei einigen Arten bis über 1 mm großen Kugeln, sind mit dem unbewaffneten Auge durchaus zu erkennen, wenn sie langsam, angetrieben durch den gleichzeitigen Wimpernschlag aller Zellen, durch das Wasser rollen.
Bei diesen Bildern handelt es sich wohl um Volvox aureus var. hemisphaerica
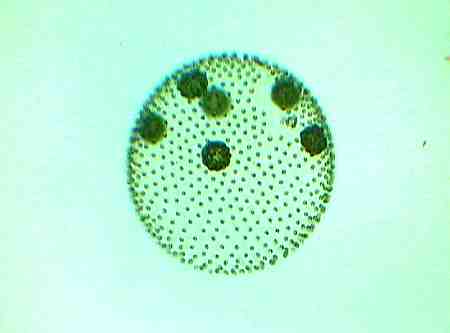
Jede Kugel besteht aus bis zu 3000 einzelnen Zellen. Innerhalb der kugelförmigen Mutterkolonie entwickeln sich die Tochterkolonien.

Die einzelnen ca. 4 µm großen Zellen sind durch hauchdünne Plasmafäden miteinander verbunden, wobei die Zellen dicht unter der Gallerthülle sitzen.
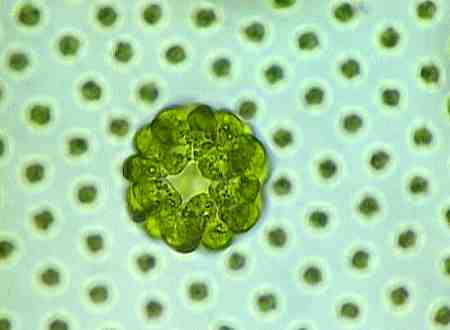
Normalerweise sind die Tochterkolonien genaue Abbilder der Mutterkolonie, also ebenfalls kugelförmige Kolonien.
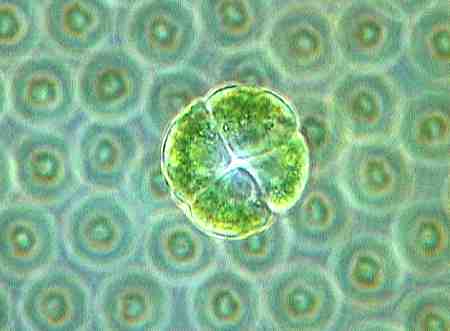
Wenn sich die Umweltbedingungen verschlechtern, werden jedoch auch Keimzellen ausgebildet, wie in diesem Fall, die dann nicht unbedingt kugelaförmig sein müssen.
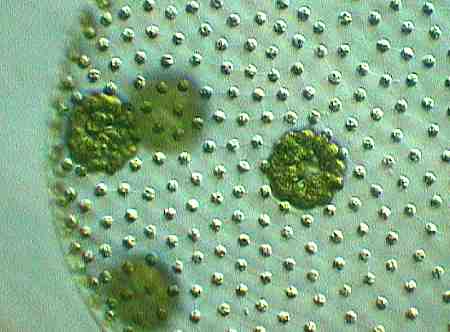
Die bis zu 10 Spermatozoidenverbände haben bei dieser Art einen Durchmesser von ca. 40 µm.
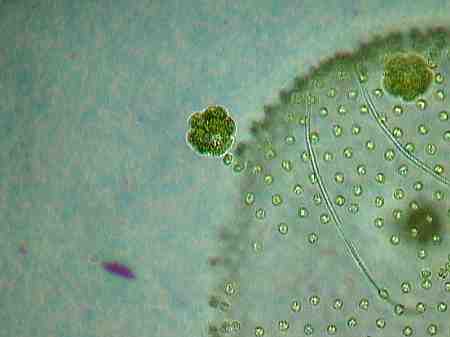
Genau wie die Tochterkolonien verlassen auch die Keimzellen als Ganzes die Mutterkugeln.
Kulturmedien
Um Reinkulturen zu erhalten sollen die Medien möglichst steril hergestellt werden. In den Originalrezepten wird daher autoklaviert.
Anstelle der Verwendung eines Autoklaven, soll es für erste Versuche genügen, die Lösungen erst 10 min zum Sieden zu erhitzen, dann in saubere Flaschen abzufüllen und dicht zu verschließen. Die Vitamine dürfen nicht mit erhitzt werden, da man die empfindlichen Stoffe sonst zerstört.
Man kann auch die blasenlos gefüllten Flaschen für 10 min im Dampfdrucktopf erhitzen (114 °C).
1. Möglichkeit
Von verschiedenen Seiten wurde die Verwendung der französischen Mineralwassers Volvic empfohlen.
2. Möglichkeit
nach Uspanski und Uspanskaja. Nach ihren Angaben scheiterten bisherige Kulturversuche oft am Eisenbedürfnis der Volvox sp.
| Inhaltsstoff | Menge |
| KNO3 (Kaliumnitrat) | 250 mg/l |
| MgSO4 (Magnesiumsulfat) | 250 mg/l |
| Ca(NO3)2 (Calciumnitrat) | 1000 mg/l |
| KH2PO4 (Kaliumdihydrogenphosphat) | 250 mg/l |
| K2CO3 (Kaliumcarbonat) | 345 mg/l |
| Fe2(SO4)3 (Eisen(III)sulfat) | 12,5 mg/l |
Die Eisenmenge oder die gesamte Nährlösung sind im Sommer 10, im Winter 20-tägig zu ersetzen.
3. Möglichkeit
modifiziert, nach L. Provasoli und I.J. Pintner, 1959, in dest. Wasser
| Inhaltsstoff | Menge |
| Ca(NO3)2 × 4 H2O (Calciumnitrat) | 118 mg/l |
| MgSO4 × 7 H2O (Magnesiumsulfat) | 40 mg/l |
| KCl (Kaliumchlorid) | 50 mg/l |
| Na2-glycerophosphat × 5 H2O | 60 mg/l |
| Glycylglycin | 500 mg/l |
| Micronährstofflösung | 6 ml |
Micronährstofflösung
| FeCl3 × 6 H2O (Eisen(III)chlorid) | 97 mg/l |
| MnCl2 × 4 H2O (Mangan(II)sulfat) | 41 mg/l |
| ZnCl2 × 6 H2O (Zinkchlorid) | 5 mg/l |
| CoCl2 × 6 H2O (Kobalt(II)chlorid) | 2 mg/l |
| Na2MoO4 × 2 H2O (Natriummolybdat) | 4 mg/l |
| EDTA-dinatriumsalz-dihydrat | 750 mg/l |
Dem fertigen Medium werden nach dem Sterilisieren noch Vitamin B1 (500 µg/l) und Vitamin B12 (5 µg/l) zugesetzt.
4. Möglichkeit
Nach einer Anleitung der „Sammlung von Algenkulturen” im Albrecht von Haller - Institut für Pflanzenwissenschaften der Universität Göttingen, Abt. Experimentelle Phykologie, zitiert von Dr. U. G. Schlösser.
Verwendet wird ursprünglich das Basalmedium mit 10 % Euglena Medium mit Vitaminen. Das wurde ursprünglich aber für eine bakterienfreie Kultur entwickelt. Da das aber für aquaristische Zwecke nicht zu erreichen ist, sollte man nur 1 bis höchstens 5 % Euglena Medium zusetzen, damit sich die Bakterien nicht allzu üppig ausbreiten.
4.1. Basalmedium
| Inhaltsstoff | Menge |
| KNO3 (Kaliumnitrat) | 200 mg/l |
| K2HPO4 (Dikaliumhydrogenphosphat) | 20 mg /l |
| MgSO4 × 7 H2O (Magnesiumsulfat) | 20 mg /l |
| Erdabkochung* | 5 ml/l |
| Mikronährstofflösung | 5 ml/l |
* Einen Kolben zu einem Drittel mit Erde aus Garten oder Laubwald füllen (aber nicht zu viel humoser Anteil), die aber keinen Dünger oder gar Pestizide enthalten darf. Der Erfolg hängt stark ab von der Auswahl geeigneter Erden, wobei hohe Lehm-Anteile eher ungünstig sind.
Es wird mit deionisiertem Wasser 5 cm hoch überschichtet und 2 mal in 24 h für eine h zum Sieden erhitzt. Danach wird dekantiert und von Partikeln durch Filtration (Kaffeefilter!) getrennt. Man füllt in kleine Gefäße, die sich gut im Dampfdrucktopf sterilisieren lassen und bewahrt sie anschließend im Kühlschrank auf.
4.2. Mikronährstofflösung
| ZnSO4 × 7 H2O (Zinksulfat) | 1 mg/l |
| MnSO4 × 4 H2O (Mangan(II)sulfat) bzw. MnSO4 × H2O |
2 mg/l bzw. 1,5 mg/l |
| H3BO3 (Borsäure) | 10 mg/l |
| Co(NO3)2 × 6 H2O (Kobalt(II)nitrat) bzw. CoSO4 × 7 H2O (Kobalt(II)sulfat) |
1 mg/l |
| CuSO4 × 5 H2O (Kupfer(II)sulfat) | 0,5 µg/l |
| FeSO4 × 7 H2O (Eisen(II)sulfat) bzw. FeSO4 × H2O |
700 mg/l bzw. 430 mg/l |
| EDTA-dinatriumsalz-dihydrat | 800 mg/l |
4.3. Euglena Medium
| NaOAc (Natriumacetat) bzw. NaOAc × 3 H2O |
1 g/l bzw. 1,7 g/l |
| Fleischextrakt | 1 g/l |
| Bacto-Tryptone** | 2 g/l |
| Hefeextrakt | 2 g/l |
| Erdabkochung (s. Basalmedium) | 30 ml/l |
**Bacto®-Tryptone („Pancreatic Digest [→ Verdauungsprodukt] of Casein especially rich in Tryptophane”). Bekannter Zusatz zu Nährböden aller Art. Erhältlich z.B. bei
Becton Dickinson
Tullastraße 8 - 12
69126 Heidelberg
Fon +49 (0 62 21) 3 05 - 2 76
Fax +49 (0 62 21) 3 05 - 4 00
Dem fertigen Medium werden nach dem Sterilisieren noch Vitamin B1 (500 µg/l) und Vitamin B12 (5 µg/l) zugesetzt.

